Tính theo phương trình hóa học lớp 8: Cách làm, công thức và ví dụ
Bài 6 KHTN lớp 8 giúp học sinh biết cách sử dụng phương trình hóa học để tính khối lượng, thể tích, số mol các chất tham gia và sản phẩm trong phản ứng.
📘 Mục lục bài học
🔹 1. Phương trình hóa học và mối quan hệ giữa các chất
Khi đã có phương trình hóa học (PTHH) cân bằng, ta có thể sử dụng hệ số để tính:
- Số mol các chất
- Khối lượng các chất
- Thể tích khí (ở điều kiện tiêu chuẩn)
Ví dụ: 2H2 + O2 → 2H2O
→ 2 mol H2 phản ứng với 1 mol O2 → tạo 2 mol H2O
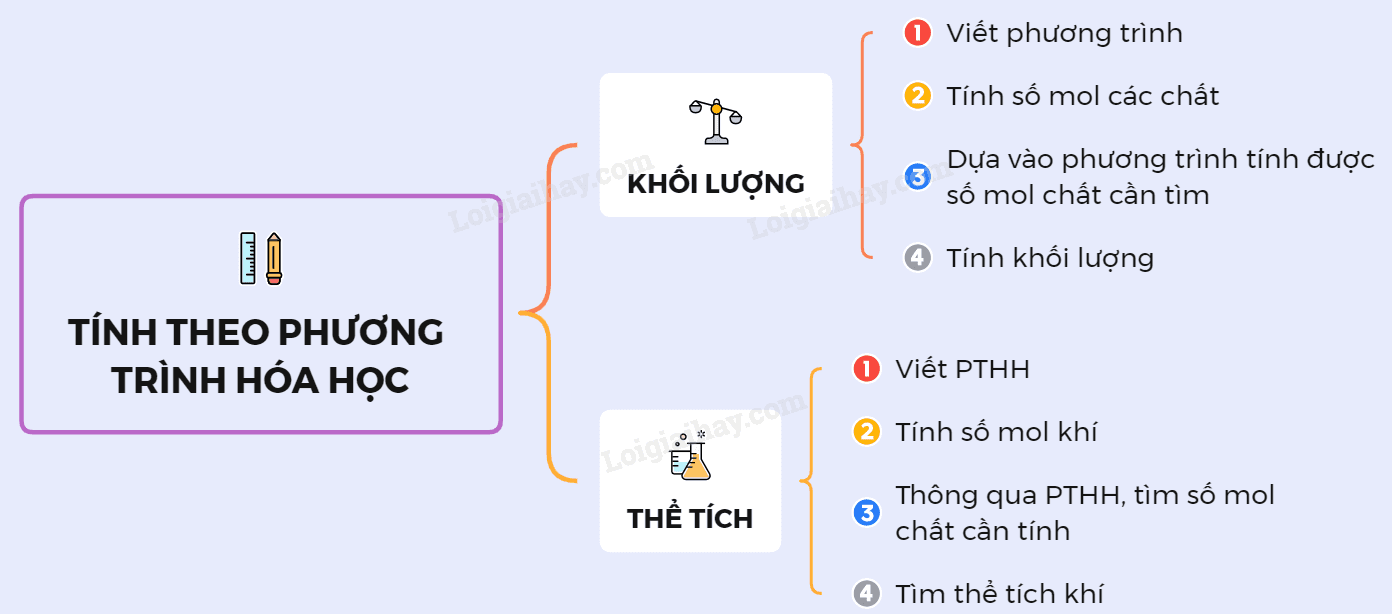
🔹 2. Các bước giải bài toán hóa học theo PTHH
- Bước 1: Viết phương trình hóa học đúng và cân bằng.
- Bước 2: Đổi các đại lượng đã cho (m, V, n) về số mol (n).
- Bước 3: Dùng tỉ lệ mol trong PTHH để tìm số mol chất cần tính.
- Bước 4: Đổi ngược từ số mol → khối lượng hoặc thể tích nếu đề yêu cầu.
🔹 3. Công thức tính cần nhớ
- n = m / M (mol) – m: khối lượng (g), M: khối lượng mol (g/mol)
- n = V / 22,4 (mol) – V: thể tích khí ở đktc (lít)
- m = n × M (g)
- V = n × 22,4 (lít) – với khí ở đktc
🔹 4. Ví dụ minh họa
- Ví dụ 1: Tính thể tích khí H2 (đktc) tạo ra khi cho 13g Zn phản ứng hết với dung dịch HCl.
– PTHH: Zn + 2HCl → ZnCl2 + H2
– nZn = 13 / 65 = 0,2 mol → nH2 = 0,2 mol
– VH2 = 0,2 × 22,4 = 4,48 lít - Ví dụ 2: Cho 44,8 lít CO2 (đktc). Tính số mol CO2 và khối lượng CO2.
– n = 44,8 / 22,4 = 2 mol
– m = 2 × 44 = 88g
🔹 5. Ghi nhớ trọng tâm & hướng dẫn học tốt
Kiến thức cần nhớ:
- Phải viết đúng và cân bằng PTHH trước khi tính toán.
- Hiểu tỉ lệ mol giữa các chất trong phản ứng.
- Áp dụng các công thức tính nhanh: m = nM, V = n×22,4,…
Gợi ý học tốt:
- Ghi nhớ khối lượng mol một số chất phổ biến (H2, O2, CO2, NaOH,…)
- Làm các bài tập từ đơn giản → nâng cao để rèn kỹ năng giải toán.
- Xem video hướng dẫn tại hocnhanhstem.com/game
- Làm trắc nghiệm luyện tập tại hocnhanhstem.com/practice
👉 Học nhanh – luyện vững – thi tốt tại hocnhanhstem.com!